Seminario 16
La lógica de la vida:
¿Homeostasis o Autopoiesis?
UNIVERSIDAD DIEGO PORTALES - ESCUELA DE MEDICINA - TALLER DE INTEGRACIÓN DE CIENCIAS BÁSICAS
Página creada por Valentina Salas B.
Última actualización: 01 de Junio de 2006
Francesca Franzini V. / Patricio Galaz M. / Valentina Salas B. / María Francisca Sales B.
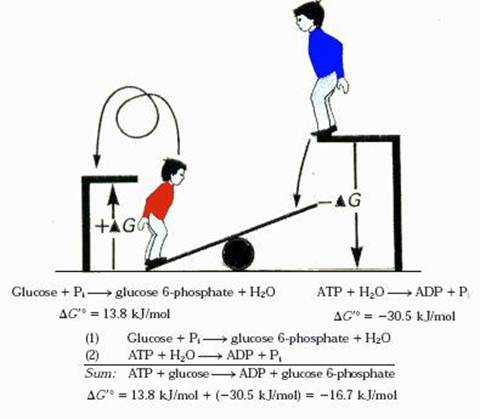
Acoplamiento Energético
En la vida diaria, muchas veces es posible ver cómo uno o más hechos desencadenan otros. Dicho en otras palabras: hay procesos que, ya que ocurren de manera natural (sin ser inducidos por otros) y a los cuales se denominará, por lo tanto, como "espontáneos", desencadenan otros procesos que de manera natural, no ocurrirían y que por esta característica (antagónica a la anterior) se nombrará como "no espontáneos".
Ese es el caso, por ejemplo, de un "sube y baja" donde hay una tabla, que al medio tiene un soporte y en cada costado un niño sentado. En este balancín un niño se encuentra arriba y otro abajo. Dado que la fuerza de gravedad hace que el niño que se encontraba arriba baje (proceso espontáneo) y que al niño que se encuentra abajo, en el otro costado, suba (proceso no espontáneo).
Ahora, llevemos este concepto a los sistemas biológicos donde ocurre un "acoplamiento energético". Este ocurre, primordialmente, a través de enzimas, que permiten que un intermediario metabólico se genere a partir de una reacción química energéticamente favorable (proceso espontáneo) y que este intermediario produzca que una reacción que es energéticamente desfavorable (proceso no espontáneo) ocurra. El hecho de que una reacción sea "energéticamente" favorable o desfavorable, esta marcado por el cambio en la "energía libre de Gibbs" (DG), que se define como: "la energía que un sistema posee para ejercer trabajo". De esta manera, si DG<0, el proceso será espontáneo, en cambio, si DG>0, entonces el proceso no lo será.
En los sistemas biológicos, muchas reacciones químicas que son energéticamente desfavorables ocupan la energía liberada por la "hidrólisis del ATP" que posee un DG muy negativo (reacción exergónica) para que sucedan de manera espontánea.